 |
TEMATYKA POKAZÓW
W LABORATORIACH
VIII FESTIWAL NAUKI
Wydział Farmaceutyczny AM w Warszawie
|
| |
Banacha 1, sobota 18.09.2004, g. 10:00
Rola endogennych opioidów w odczuwaniu bólu
Wykład wprowadzający
(prof. ndzw. dr hab. Helena Makulska-Nowak)1
Ból pełni w organizmie ważną fizjologiczną rolę
sygnalizacyjną, jednak zbyt silny lub przewlekle utrzymujący się uczestniczy w
wielu zjawiskach patologicznych. Okazuje się, że w układzie nerwowym występują
naturalne substancje przeciwbólowe łączące się z tymi samymi receptorami, co
morfina.
Doświadczalne potwierdzenie istnienia receptora opioidowego w początkach lat
siedemdziesiątych zapoczątkowało intensywne poszukiwania związków, wytwarzanych
w organizmach ludzi i zwierząt, które w warunkach fizjologicznych mogą łączyć
się z tym receptorem. Badania doprowadziły do odkrycia związków o właściwościach
morfinopodobnych w różnych tkankach, głównie w mózgu, przysadce i rdzeniu
kręgowym. Dla tych wszystkich substancji przyjęto ogólną nazwę "endorfiny",
wywodzącą się z połączenia słów "endogenne" i "morfiny".
Odkrycie opioidów zapoczątkowało określenie budowy dwóch peptydów endogennych
wyodrębnionych przez Hughesa w 1975 roku, które nazwano enkefalinami. Wraz z tym
odkryciem rozpoczął się jeden z najważniejszych etapów w rozwoju badań nad
percepcją bólu oraz mechanizmami działań opioidów.
W ślad za odkrywaniem kolejnych endogennych opioidów prowadzono intensywne
badania nad ich właściwościami i znaczeniem w stanach fizjologicznych i
patologicznych organizmu. Pomimo znacznego postępu wiedzy o endorfinach, ich
rola nie jest w pełni poznana. Wiadomo, że mogą one pełnić rolę zarówno
neuroprzekaźników, jak i neuromodulatorów. Wykazano ich udział w wielu ważnych
czynnościach życiowych - tym związkom przypisuje się nie tylko fizjologiczną
rolę w percepcji bólu, ale także w mechanizmach stresu, zjawiskach
immunologicznych, regulacji łaknienia, temperatury ciała, czynności układu
krążenia i układu oddechowego, w procesach uczenia i pamięci, a także w
regulacji nastroju.
Przypuszcza się, że endorfiny biorą także udział w patofizjologii niektórych
chorób.
Endogenne opioidy (endorfiny) hamują rozprzestrzenianie się impulsów bólowych
poprzez wiązanie z receptorami opioidowymi. Znajomość mechanizmów ich działań
być może umożliwi opracowanie skuteczniejszych i bezpieczniejszych metod
łagodzenia bólu zarówno ostrego, jak i przewlekłego.
Pod koniec wykładu odbyła się dyskusja, a następnie rozpoczęły się pokazy laboratoryjne w
siedmiu równoległych sekcjach.
|
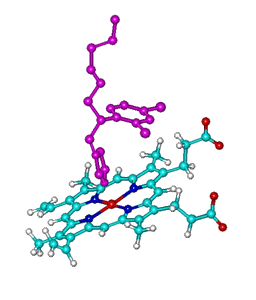 Obraz
molekularny pochodnej imidazolu o działaniu przeciwgrzybiczym w centrum aktywnym
cytochromu P450. |
Banacha 1, sobota 18.09.2004, g. 11, 12 i 13:00
Leki w świecie wirtualnym – metody obliczeniowe w
farmacji
(prof. ndzw. dr hab. Dorota Maciejewska,
mgr Teresa Żołek)2
W miarę wzrostu mocy obliczeniowej komputerów i doskonalenia oprogramowania
stało się możliwe odwzorowywanie wielu złożonych procesów. Dziś już nikogo nie
dziwi fakt, że można numerycznie symulować wybuchy jądrowe lub przewidywać
sposób zgniatania karoserii samochodowych, zamiast przeprowadzać odpowiednie
eksperymenty. Również w chemii i farmacji z coraz lepszymi wynikami stosuje się
matematyczne modelowanie procesów, przebiegających na poziomie molekularnym.
Cechą współczesnej nauki jest zanik wyraźnych granic między poszczególnymi
dyscyplinami naukowymi, a szczególnie ważną, integrującą rolę w naukach
biologicznych odgrywają teorie fizyki opisujące oddziaływania między atomami i
cząsteczkami. Jeśli znany jest mechanizm oddziaływania leku z centrum aktywnym w
organizmie (receptorem), można modelować podobne procesy przy użyciu innych,
potencjalnych środków leczniczych, przewidując ich aktywność lub jej brak.
Podczas prezentacji przedstawiono różne metody wykorzystywane w projektowaniu
leków oraz analizie budowy przestrzennej i właściwości molekuł. Uczestnicy
spotkania mogli sprawdzić możliwości jednego z programów obliczeniowych
oraz przetestować swoją wyobraźnię.
|
|

Wyciąg z aktywnej herbaty, wykazującej właściwości przeciwrodnikowe,
przygotowany do pomiaru. |
Banacha 1, sobota 18.09.2004, g. 11, 12 i 13:00
Pomiar zmiatania wolnych rodników przez wina i
herbaty
(dr Marek Wasek, mgr
inż. Jerzy Gierczyk)3
Jeszcze kilkadziesiąt lat temu tlen był uważany wyłącznie za
pierwiastek niezbędny do życia. Nikt nie przypuszczał, że w stężeniu większym
niż występuje w warunkach naturalnych, niektóre jego formy mogą być czynnikiem
niszczącym życie. Odkrycie toksyczności tlenu było związane ze stwierdzeniem
obecności wolnych rodników tlenowych w zdrowych organizmach. Powodują one
uszkodzenia komórek i są szczególnie niebezpieczne dla jądra komórkowego i
mitochondriów. Opublikowano wiele prac dowodzących, że rak, arterioskleroza, choroba
Alzheimera czy Parkinsona mogą być związane z malejącą odpornością na działanie
rodników w komórkach.
Antyoksydanty (przeciwutleniacze) eliminują wolne rodniki. Bardzo ważne jest
więc stosowanie diety bogatej w antyutleniacze takie jak witamina C i E,
karoteny, a również związki typu polifenoli. Związki polifenolowe takie jak:
flawonoidy, antocyjany czy taniny wykazują właściwości antyutleniające,
neutralizując powstające w tkankach wolne rodniki. Surowce aktywne zawierające
polifenole są często głównym składnikiem wielu mieszanek ziołowych, herbat oraz
preparatów leczniczych naturalnego pochodzenia, które mogą być stosowane jako
dodatki do żywności. Okazuje się, że soki i wina owocowe również wykazują
właściwości przeciwutleniające.
W trakcie pokazu wspólnie
przyprowadzono pomiary właściwości przeciwutleniających herbat i win. Do tego
celu wykorzystano technikę elektronowego rezonansu paramagnetycznego (EPR), za
pomocą której można wykrywać i ilościowo oznaczać związki, zawierające
niesparowany elektron, czyli wolne rodniki. Substancje antyoksydacyjne powodują
zanikanie sygnałów rodników w czasie, tym szybciej, im większa jest ich
aktywność.
|
 Kwiatostany
(szyszki) chmielu zwyczajnego (Humulus lupulus). Wyciąg z tego surowca wykazuje
działanie uspokajające. |
Banacha 1, sobota 18.09.2004, g. 11, 12 i 13:00
Izolacja olejków eterycznych z roślin leczniczych
(dr Jan Malinowski)4
Niektóre rośliny, stosowane w lecznictwie, swoje
właściwości terapeutyczne zawdzięczają olejkom - lotnym, a więc pachnącym,
zespołom składników naturalnych. Olejki eteryczne cechuje lotność także z parą
wodną, dlatego ich napary są aromatyczne i wonne. Lotność wykorzystuje się do
wyodrębnienia olejków z surowca roślinnego, np. z liści czy korzeni. Otrzymana
ciecz jest mieszaniną związków chemicznych, czasem zawiera ich nawet ponad
pięćdziesiąt, lecz zwykle jeden składnik jest dominujący. Na przykład olejek z
liści mięty zawiera jako główny składnik mentol, olejek z owoców kminku - karwon,
a olejek z kwiatostanów rumianku - chamazulen.
Olejki roślinne znalazły szerokie zastosowanie w lecznictwie. Wykazują m. in.
działanie wykrztuśne, przeciwzapalne, spazmolityczne, zwiększające wydzielanie
soku żołądkowego, żółci oraz moczu. Stosuje się je w leczeniu schorzeń górnych
dróg oddechowych, stanów zapalnych i innych chorób przewodu pokarmowego, a także
jako środki żółcio- i moczopędne. Olejki wykorzystuje się także w przemyśle
kosmetycznym, perfumeryjnym i spożywczym. Wiele popularnych przypraw kulinarnych
to surowce roślinne, zawierające olejki eteryczne.
W trakcie pokazu wyodrębniano olejki z surowców roślinnych,
rozdzielano olejek na składniki i określano jego skład przy zastosowaniu metody
chromatograficznej. Był też czas na dyskusję i pytania.
|
 Różeniec
hodowany na pożywce agarowej (agar, makro- i mikroelementy, hormony, witaminy i
inne składniki)

Biofermentor do hodowli niezróżnicowanych komórek roślinnych (kalusa).

Kalus, czyli niezróżnicowana tkanka roślinna. |
Banacha 1, sobota 18.09.2004, g. 11, 12 i 13:00
Biotechnologia roślin leczniczych
(przygotowanie: prof. dr hab. Mirosława Furmanowa, dr Hanna Olędzka,
prowadzenie: dr Hanna Olędzka, mgr Wojciech Szypuła)5
Naturalnym środowiskiem bytowania roślin, z
którym stykamy się najczęściej, jest gleba. Obecnie istnieje jeszcze inna
możliwość hodowli roślin - w warunkach sterylnych, przy zastosowaniu pożywki
agarowej zamiast ziemi. W takim przypadku mówimy o hodowli in vitro,
czyli w szkle. Metoda ta jest m. in. stosowana do szybkiego klonalnego mnożenia
roślin, tj. otrzymywania wielu okazów potomnych z tkanki jednej rośliny.
Istnieje także możliwość osobnego hodowania wyodrębnionych organów tkanek i
komórek roślinnych, np. samych korzeni, zarodków lub komórek. Ponadto, zamiast
roślin lub ich organów można również hodować niezróżnicowaną tkankę, nazywaną
kalusem, lub prowadzić hodowlę komórek w zawiesinie w tzw. bioreaktorach. W
tkankach wyhodowanych in vitro występują na ogół w podobnej ilości takie
same związki biologicznie czynne, jak w roślinie macierzystej, co umożliwia
otrzymanie ich z pominięciem hodowli całej rośliny. Najlepsze wyniki uzyskuje
się z kultury zawiesinowej w bioreaktorach, w których parametry wzrostu są
automatycznie rejestrowane i kontrolowane zewnętrznie na monitorze.
Według jednej z najnowszych metod, związki lecznicze otrzymuje się z korzeni
transgenicznych, tzn. mających wprowadzony obcy gen. Do modyfikacji genotypu
używa się bakterii o nazwie Agrobacterium rhizogenes. Organizmy
modyfikowane genetycznie (GMO - genetically modified organisms)
otrzymywane są obecnie z bakterii, grzybów, roślin i zwierząt. Dostarczają one
m.in. wielu produktów żywnościowych, obecnych na naszym rynku. Zasady
postępowania regulowane są specjalnymi przepisami, według których na opakowaniu
powinna być informacja, że artykuł pochodzi z roślin zmienionych genetycznie.
Hodowla tkankowa roślin in vitro pozwala również otrzymywać rośliny haploidalne (z pojedynczym zespołem chromosomów), a także dokonywać fuzji
protoplastów (nieobłonionych komórek) dwóch gatunków, nie dających mieszańców w
stanie naturalnym. Tkanki można zamrażać i przechowywać w temperaturze ciekłego
azotu (-196oC), a po powolnym rozmrożeniu kontynuować hodowlę. Można
również otoczkować tkanki merystematyczne i przechowywać w stanie niezmienionym
w niskiej temperaturze dodatniej w formie tzw. sztucznych nasion.
Badania Katedry obejmują poszukiwania związków naturalnych o właściwościach
cytostatycznych i immunomodulujących, które tworzą się w hodowli in vitro.
Obecnie przedmiotem prac są różne gatunki cisa i inne rośliny nierosnące masowo
w Polsce. Cis zawiera ok. 350 związków chemicznych, z których wiele jest
trujących, natomiast jeden, paklitaksel, wykazuje właściwości
przeciwnowotworowe. Związek ten powstaje również w hodowli in vitro. Jego
obecność stwierdziliśmy w korzeniach transformowanych w ilości równej jego
występowaniu w korze.
Biotechnologia jest przedmiotem zajęć dydaktycznych i badań naukowych dwóch
Katedr Wydziału Farmaceutycznego - Katedry i Zakładu Biologii i Botaniki
Farmaceutycznej, która zajmuje się biotechnologią roślinną oraz Katedry
Technologii Środków Leczniczych, która zajmuje się biotechnologią
mikroorganizmów i hodowlą grzybów.
W trakcie pokazu zostały zademonstrowane hodowle tkankowe w bioreaktorach oraz
hodowle roślin transgenicznych. Nie zabrakło również czasu na dyskusję o
uzyskiwaniu związków biologicznie czynnych z roślin.
|
| . |
Banacha 1, sobota 18.09.2004, g. 11, 12 i 13:00
Nowoczesne diagnozowanie alergii
(dr Sławomir Białek, mgr Katarzyna Gosk)6
Diagnostyka laboratoryjna jest działem medycyny zajmującym się dostarczaniem
informacji ułatwiających bądź umożliwiających rozpoznanie i różnicowanie chorób,
oraz prognozowanie i monitorowanie leczenia. W przypadku chorób alergicznych
diagnoza przede wszystkim opiera się na wynikach prawidłowo przeprowadzonego
wywiadu oraz na wynikach testów skórnych. Często zdarza się jednak, że obraz
kliniczny nie jest potwierdzony dodatnim wynikiem testów skórnych i w takich
przypadkach konieczne jest wykonanie badań laboratoryjnych, czyli oznaczenia w
surowicy krwi całkowitego stężenia IgE (immunoglobuliny E) oraz stężenia
immunoglobulin alergenowoswoistych.
Stężenie immunoglobuliny E w surowicy krwi jest parametrem niezwykle
charakterystycznym dla procesu alergicznego. Już u małych dzieci (od trzeciego
roku życia), u których obserwuje się objawy alergii pokarmowej, można wykonać
oznaczenie IgE. Wysoki poziom IgE obserwuje się także u młodych dorosłych z
objawami alergii na alergeny wziewne, a także u pacjentów z astmą atopową.
W trakcie tegorocznego Festiwalu Nauki w trakcie pokazów laboratoryjnych
została zaprezentowana metoda oznaczania IgE alergenowoswoistych.
|
 Przygotowywanie
żelu kosmetycznego z dodatkiem unisfer, zawierających witaminę E. |
Banacha 1, sobota 18.09.2004, g. 11, 12 i 13:00
Przygotowanie żelu dla młodzieży
(mgr Anna Żebrowska-Szulc, dr Barbara Chałasińska)7
Działanie kremów
kosmetycznych, przeznaczonych do pielęgnacji skóry, polega na jej natłuszczaniu,
nawadnianiu i odżywianiu, a w rezultacie na uelastycznieniu i wygładzeniu.
Wartość odżywczą kremów podnosi dodatek substancji biologicznie czynnych:
witamin, aminokwasów, hormonów, enzymów, kompleksów białkowych oraz wyciągów
roślinnych.
Krem-żel dla młodzieży,
który otrzymywano w trakcie pokazu, zawiera wyciąg z owoców Limonki (Fruitliquid
Lime PG), wyciąg z liści Mięty pieprzowej (Phytoliquid Peppermint BG)
oraz witaminę E. Witamina E stosowano w postaci unisfer, będących
barwnymi kulistymi peletkami o średnicy od 0,5 do 0,9 mm, pełniących rolę
nośników wielu aktywnych substancji. Unisfery używane w preparatach
kosmetycznych różnego typu dodatkowo nadają im barwną pigmentację.
|
| . |
Banacha 1, sobota 18.09.2004, g. 11, 12 i 13:00
Ocena toksyczności środowiska przy użyciu organizmów
wodnych
(dr Grzegorz Nałęcz-Jawecki)8
Bioindykacja jest metodą wykorzystującą jako
wskaźnik organizm żywy, którego reakcja jest podstawą oceny stopnia toksyczności
badanego środowiska. Organizmy testowe, zwane bioindykatorami, powinny być
szczególnie wrażliwe na związki chemiczne szkodliwe dla środowiska i dla
człowieka, a w celu poprawienia tych właściwości są one często modyfikowane
genetycznie. Uzyskanie wyniku dodatniego przy ich zastosowaniu stanowi rodzaj
alarmu, ostrzegającego przed przypadkowym bądź umyślnym skażeniem, i pozwala na
ocenę całkowitej toksyczności próbki. Bioindykację można więc traktować jako
wstęp do analizy chemicznej, która pozwala na wykrycie obecności tylko tych
związków, których się spodziewamy.
Można wyróżnić dwa podstawowe rodzaje metod bioindykacyjnych. Pierwszy, tzw.
środowiskowy, ma na celu ocenę stanu środowiska przyrodniczego oraz wpływu
substancji chemicznych, zwłaszcza pestycydów, detergentów oraz metali ciężkich,
na różne organizmy żywe, drugi dotyczy głównie człowieka. Bioindykatory,
specjalnie wyselekcjonowane pod kątem szczególnie wysokiej wrażliwości,
wprowadzone zostały w wielu krajach do rutynowych badań wód i służą do
zabezpieczenia ujęć wody pitnej przed przypadkowym bądź umyślnym
zanieczyszczeniem.
W biotestach, służących do badania toksyczności wody lub ścieków, stosuje się
bioindykatory zwierzęce, roślinne i bakteryjne. Poniżej przedstawiamy pięć
przykładowych testów, zaprezentowanych w trakcie pokazów w naszym
laboratorium.
Test przy użyciu Selenastrum capricornutum.
W teście wykorzystywany jest jednokomórkowy glon, należący do gromady zielenic,
rozpowszechniony w wodach słodkich. Do hodowli glonów wprowadza się badane
próbki wód powierzchniowych, a następnie prowadzi się spektrofotometryczne
pomiary absorbancji w zakresie widzialnym. Toksyczne oddziaływanie badanej
próbki powoduje zahamowanie przyrostu glonów, co można ilościowo mierzyć w
odniesieniu do próbki kontrolnej. Przeciwny efekt testowy, czyli nadmierny
wzrost glonów, jest także niekorzystny, bo może świadczyć o obecności substancji
biogennych, jak nawozy czy fosforany ze środków piorących. Metodyka oparta jest
na normie ISO 8692:1989.
Test przy użyciu Daphna magna.
Rozwielitka jest skorupiakiem żyjącym w wodach słodkich. Stanowi dobry
bioindykator z uwagi na łatwość hodowli oraz dużą wrażliwość na obecność wielu
substancji toksycznych, w szczególności insektycydów, na które reaguje już w
stężeniach 0,0001 mg/l. Efektem testowym jest unieruchomienie organizmu. Dafnie
są często wykorzystywane w układach przepływowych w stacjach zabezpieczających
ujęcia wody pitnej. Metodyka została oparta na normie ISO 6341:1996.
Test przy użyciu Artemia salina.
Artemia, inaczej solowiec, jest skorupiakiem żyjącym w wodach słonych.
Charakteryzuje się mniejszą wrażliwością niż dafnia, lecz jego niewątpliwą
zaletą jest możliwość uzyskiwania młodych organizmów z jaj przetrwalnych. Aby
uzyskać wylęg Artemii należy dzień przed wykonaniem testu umieścić jaja w
specjalnej pożywce. Dzięki temu nie jest konieczne prowadzenie kosztownej,
ciągłej hodowli bioindykatorów.
Test Spirotox.
Organizmem testowym jest pierwotniak z grupy orzęsków - Spirostomum ambiguum,
występujący w małych, czystych stawach. Orzęski umieszczane są w badanej próbce
w płaskich naczyniach i obserwowane pod niewielkim powiększeniem (8 x). Po
wpływem toksykantów komórki organizmów ulegają rozpuszczeniu, tzw. lizie.
Bioindykator jest szczególnie wrażliwy na metale ciężkie, fungicydy (środki
grzybobójcze) i detergenty. Z uwagi na niewielkie rozmiary organizmów reakcja
przebiega szybko - oznaczenie trwa kilkanaście do kilkudziesięciu minut.
Test Microtox.
Test polega na pomiarze naturalnej luminescencji (świecenia) bakterii Vibrio
fischeri, które są zawieszone w badanej próbce. Toksyczne związki chemiczne
hamują aktywność enzymów bakteryjnych, co manifestuje się obniżeniem
intensywności świecenia. Jest to najszybszy test bioindykacyjny - wyniki
uzyskujemy już po 5 minutach. Jego wadą jest konieczność zastosowania kosztownej
aparatury, tzw. luminometru. Metodyka oparta jest na normie ISO 11348:1998.
|
| . |
|
| . |
Adresy i telefony:
1
Zakład Farmakodynamiki, Wydział Farmaceutyczny, Akademia Medyczna w Warszawie,
ul. Krakowskie Przedmieście 26/28, 00-325 Warszawa, e-mail: <maknow@amwaw.edu.pl>;
kierownik: prof. dr hab. Stanisław W. Gumułka.
2 Katedra i Zakład Chemii Organicznej, Wydział Farmaceutyczny,
Akademia Medyczna w Warszawie, ul. Banacha 1, 02-097 Warszawa, tel. 572 0643,
kierownik prof. ndzw. dr hab. Dorota Maciejewska.
3 Zakład Chemii Fizycznej, Wydział Farmaceutyczny, Akademia Medyczna
w Warszawie, ul. Banacha 1, 02-097 Warszawa, tel. 5720 961, kierownik prof.
ndzw. dr hab. Iwona Wawer.
4 Katedra i Zakład Farmakognozji, Akademia Medyczna w Warszawie, ul.
Banacha 1, 02-097 Warszawa, tel./faks 5720 985, kierownik: prof. ndzw. dr hab.
Józef Kowalski.
5 Katedra i Zakład Biologii i Botaniki Farmaceutycznej,
Wydział Farmaceutyczny, Akademia Medyczna w Warszawie, ul. Banacha 1, 02-097
Warszawa, tel./faks 5720 984, kierownik: prof. ndzw. dr hab. Olga Olszowska.
6
Katedra i Zakład Biochemii i
Chemii Klinicznej, Akademia Medyczna w Warszawie, ul. Banacha 1, 02-097
Warszawa, tel./faks 5720 737, kierownik: prof. dr hab. Jan Pachecka.
7 Zakład Farmacji Stosowanej, Wydział Farmaceutyczny, Akademia
Medyczna w Warszawie, ul. Banacha 1, 02-097 Warszawa, tel./faks 5720 978,
kierownik: prof. ndzw. dr hab. Edmund Sieradzki.
8Zakład Badania Środowiska, Wydział Farmaceutyczny, Akademia
Medyczna w Warszawie, ul. Banacha 1, 02-097 Warszawa, tel. 5720 738, kierownik:
prof. ndzw. dr hab. Józef Sawicki.
|







